这是Microblox的第56篇微流控推文。
近年来,“在芯片上进行免疫染色”这样的实验备受关注。细胞固定和免疫染色是细胞生物学和生物医学研究中的关键技术。
细胞固定是将细胞固定在特定状态以保持其形态,并防止进一步变化的过程。这一过程对于研究细胞结构至关重要,因为它能帮助研究人员在特定时间点“捕捉”细胞的状态。固定还能灭活细胞内的酶,防止进一步的生化反应,从而保持细胞成分的完整性。这对于防止降解、维持细胞稳定性以及后续实验分析非常重要。此外,固定后的细胞可以长期保存,提供更灵活的实验操作时间。
免疫染色是一种利用抗体检测和可视化细胞内特定蛋白的技术。这项技术对于研究目标蛋白的存在、位置及其表达水平具有重要意义。此外,免疫染色还能提供蛋白在细胞中的空间分布信息,使研究人员可以在显微镜下分析图像,并量化细胞的形态、方向、荧光强度和距离等参数。
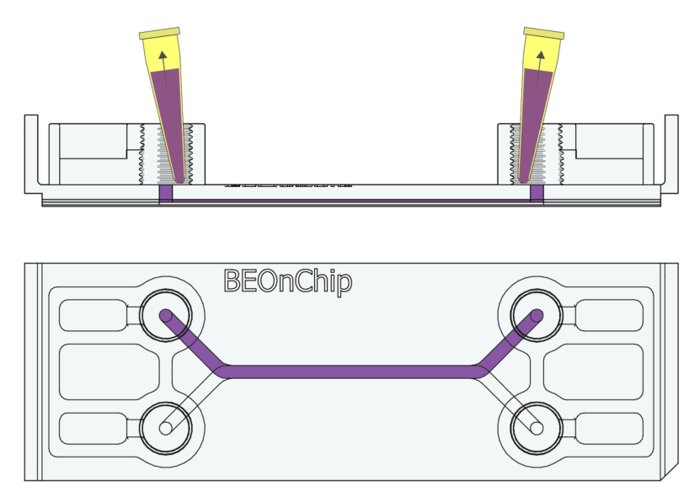
本文接下来详细介绍如何在Be-DoubleFlow芯片(图1)上培养的肠道细胞(HT29-MTX 和 Caco2)进行细胞固定和荧光标记实验。本次实验的目标是标记Mucin 2(MUC2)和Zonula Occludens(ZO-1)蛋白,以评估细胞屏障的完整性。

图1. Be-flow芯片
在细胞培养实验结束时(细胞已经培养或处理到适当的阶段,准备进行固定和免疫染色),使用4% 多聚甲醛(PFA)固定细胞。
多聚甲醛(PFA)的作用:
· 固定并保存细胞结构,包括蛋白质、脂质和核酸,使其形态和组织保持稳定。
· 适用于荧光显微镜,可保留荧光蛋白和染料的荧光信号,便于后续标记检测。
具体步骤:
1. 去除培养基:从培养基储存槽及进出口孔中吸出培养基,但保留流道中的培养基(可以保护细胞免受干燥损伤,减少液体冲刷造成的应力,并优化固定液的渗透效果、防止气泡产生)。
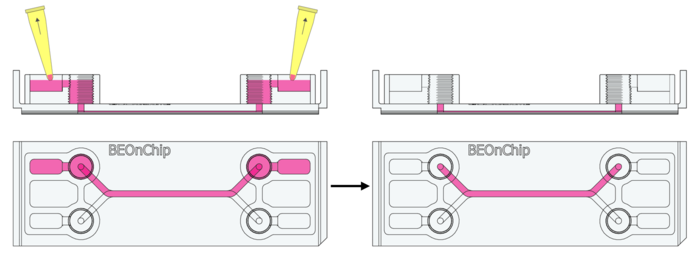
2. PBS 清洗:加入 300 µL PBS,并手动轻轻倾斜芯片,使培养基稀释并清洗流道。
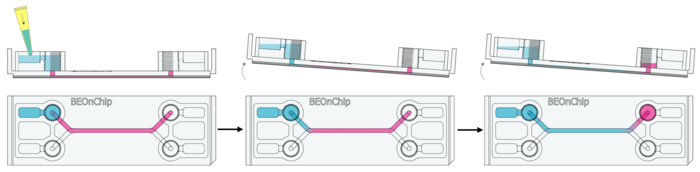
3. 重复清洗:出液口去除 PBS 后,重复清洗步骤,确保培养基被彻底去除。
4. 添加固定液:
o 向进液孔加入 100 µL PFA,并倾斜芯片,使其流动至出口孔。
o 从出口孔吸取 100 µL PFA,并重复以上过程一次。
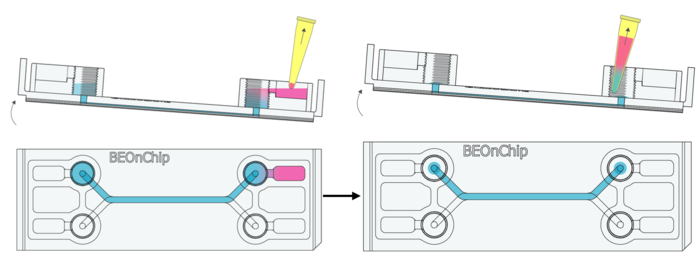
说明:以上步骤可选方案(不推荐):先完全去除流道内的 PBS,然后加入 50 µL PFA(取决于芯片内部体积),但必须确保流道完全排空,以防止在重新注入 PFA 时产生过高压力或气泡损伤细胞。
5. 孵育 15-20 分钟,让 PFA 充分固定细胞。
6. 去除 PFA,但保持流道充满固定液。
7. PBS 清洗:与步骤 2 相同,使用 PBS 清洗芯片三次,以去除残留的 PFA。
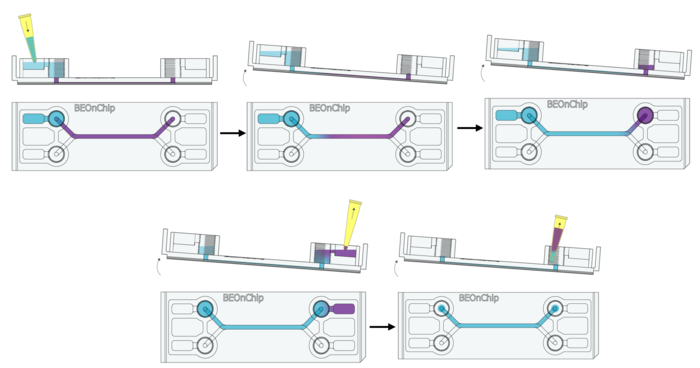
透化的作用:
· 使抗体能够进入细胞内部,与目标蛋白结合。
· 采用非离子型去污剂(Triton X-100)进行处理,使细胞膜形成小孔。
具体步骤:
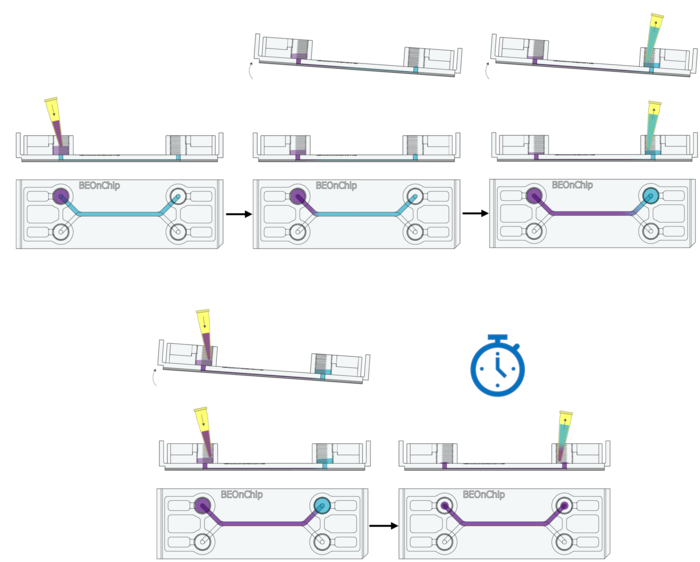
8. 加入 0.1% Triton X-100(100 µL)到进液孔,并倾斜芯片,使其流动至出口孔,出口孔移除Triton X-100。重复此步骤一次。
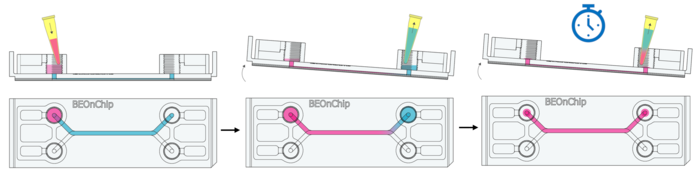
9. 室温孵育 10 分钟,确保细胞完全透化。
10. 去除进液孔和出口孔的 Triton X-100,但保留流道内溶液。
11. 清洗:使用 0.05% Tween 20(PBS 配制)进行温和洗涤,倾斜芯片以增强洗涤效果,并重复 3 次。
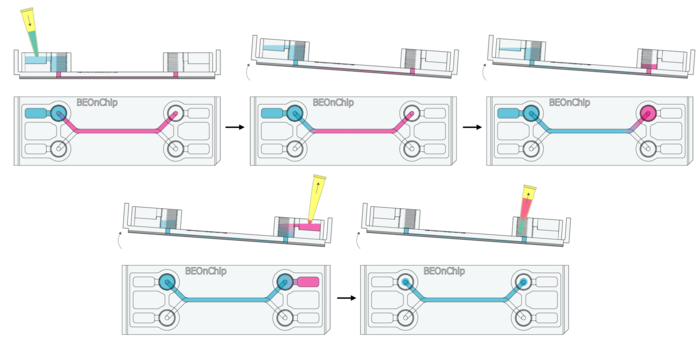
封闭的作用:
· 避免抗体非特异性结合,减少背景噪声,提高检测的准确性和灵敏度。
· 使用5% 牛血清白蛋白(BSA,A9418)进行封闭。
具体步骤:
12. 加入 100 µL BSA 到进液孔,并倾斜芯片使其流动至出口孔,重复一次。
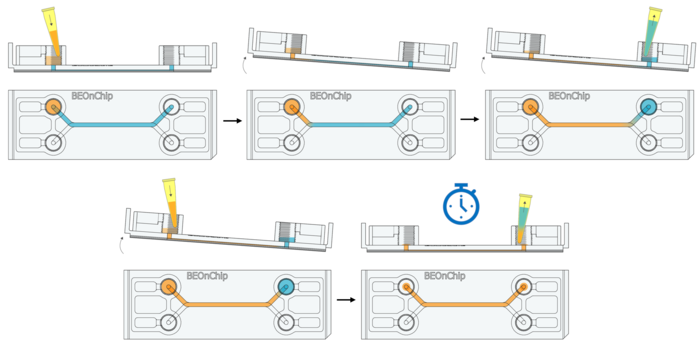
13. 室温孵育 2 小时(2D/2.5D 细胞培养推荐 2-4 小时,3D 培养可适当延长)。
14. 去除 BSA,确保通道完全排空(倾斜芯片、轻微抽取),无残留液体或气泡,以免影响抗体的注入。
目标蛋白标记:
· MUC2(Mucin 2):小鼠单克隆抗体(sc-515032)
· ZO-1(Zonula Occludens 1):大鼠单克隆抗体(Invitrogen 402200)
· 一抗稀释比例:1:100
· 二抗:
o Alexa Fluor 488(山羊抗小鼠,A11001,Life Technologies)
o Alexa Fluor 488(山羊抗大鼠,1:500)
· 二抗稀释液:0.5% BSA
具体步骤:
15. 注入一抗(约 50 µL),通过微流控芯片进液孔填充流道,在4°C 过夜孵育。
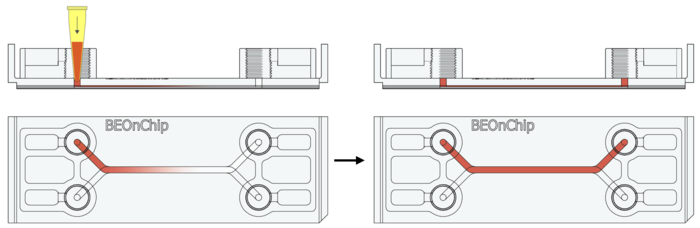
16. BSA 清洗:使用 0.5% BSA按步骤 2 和 3 进行多次清洗,排空流道。
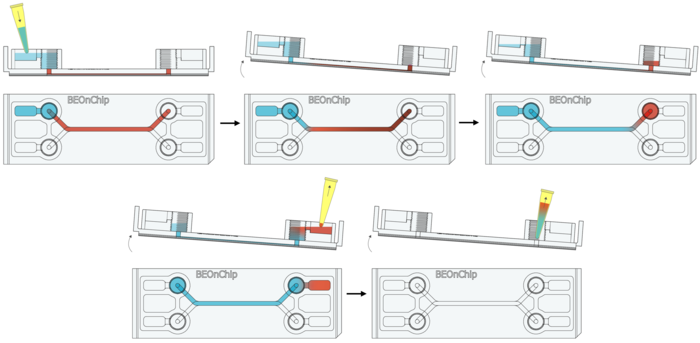
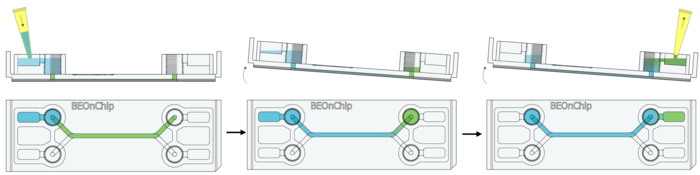
17. 注入二抗(50 µL),室温孵育 2-3 小时,避光。
18. 清洗:先用 0.5% BSA 清洗,然后再用 PBS 再次清洗。
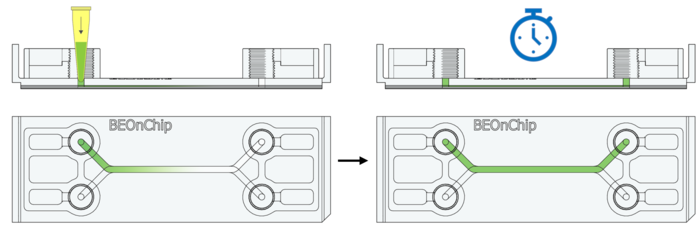
19. DAPI荧光染料染核:DAPI(Sigma Aldrich D9542,1:1000),通过微流控芯片的进液孔缓慢注入适量 DAPI 染色液(约 50 µL,具体取决于芯片内部体积)。室温孵育 1 小时。
对照实验:如果可能,建议进行阴性对照实验,仅使用二抗(不加入一抗),特别是在 MUC2 等标记物的实验中,以区分背景噪声与真正的粘蛋白表达信号。。
显微镜观察:采用 Leica Thunder 荧光显微镜,20X 物镜拍摄图像。
如图 2 所示,在微流控芯片培养的 HT29-MTX 和 Caco2 细胞中,成功检测到 Mucin 2 和 Zonula Occludens 的表达,证明了上皮屏障的完整性。
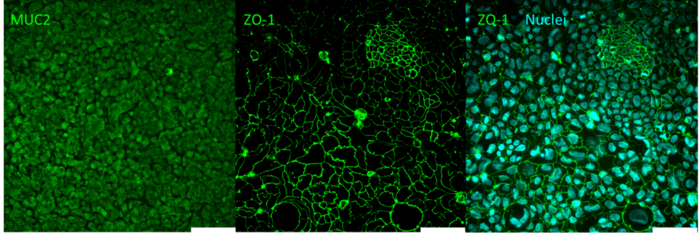
图 2. 微流控芯片中 HT29-MTX/Caco2 细胞的荧光显微镜图像。MUC2 和 ZO-1 的免疫组织化学染色。ZO-1 与 DAPI 标记的细胞核合并显示。比例尺:100 µm。
MUC2是一种重要的分泌型糖蛋白,在形成保护性粘液层方面起关键作用,该粘液层覆盖并保护肠道上皮,同时提供润滑功能。MUC2 的表达对于精准模拟人体肠道特性至关重要,它是研究体外生理环境再现时不可或缺的标志物 [1]。
Zonula occludens(ZO),也称为紧密连接,是一类细胞骨架连接蛋白,它们与细胞质膜周边蛋白(如 occludin 和 claudin)相互作用,形成稳固的交联结构,并与膜骨架(由 F-actin 和肌球蛋白组成)连接。此外,紧密连接蛋白还与细胞内信号传导蛋白协同作用,调控多种细胞过程,以维持屏障完整性和调节通透性。
在体外培养中,ZO-1 的存在有助于模拟肠道屏障功能,并用于研究其调控机制。例如,不同的化合物(如药物或营养物质)对肠道通透性和屏障完整性的影响可通过检测 ZO-1 表达水平进行评估 [2]。
此外,肠道屏障和粘液层在调节免疫反应及与肠道微生物群的相互作用中起着至关重要的作用。在体外培养体系中研究 MUC2 和 ZO-1 的表达,可用于分析这些结构的变化如何影响免疫系统及微生物群的组成 [3,4]。
另一方面,在体外系统中维持 MUC2 和 ZO-1 的表达,使得研究克罗恩病(Crohn’s disease)、溃疡性结肠炎(ulcerative colitis)以及其他胃肠道疾病成为可能。这为评估潜在疗法并深入理解这些疾病的机制提供了合适的测试环境 [5]。
本研究结果表明,通过微流控芯片,能够显著提高对体外肠道培养条件的控制精度,可更精准地调节液体流动和机械力,从而简化特定生理条件的模拟过程 [6]。此外,已有研究报道,剪切力可刺激粘液分泌,并增强微流控芯片中紧密连接蛋白的表达 [7]。
本实验验证了在 Be-DoubleFlow芯片上进行芯片内固定与免疫染色的可行性,并成功检测到了肠道屏障相关蛋白 MUC2 和 ZO-1。该方法适用于所有 Beonchip 芯片,能够更精确地模拟体内环境,为肠道研究提供可靠的体外模型。
相关文献:
1. L. Sardelli, D. P. Pacheco, A. Ziccarelli, M. Tunesi, O. Caspani, A. Fusari, F. Briatico Vangosa, C. Giordano and P. Petrini, RSC Adv., 2019, 9, 15887–15899.
2. C. Chelakkot, J. Ghim and S. H. Ryu, Exp. Mol. Med., 2018, 50, 103.
3. T. Paradis, H. Bègue, L. Basmaciyan, F. Dalle and F. Bon, Int. J. Mol. Sci., 2021, 22, 1–21.
4. M. Calvigioni, A. Panattoni, F. Biagini, L. Donati, D. Mazzantini, M. Massimino, C. Daddi, F. Celandroni, G. Vozzi and E. Ghelardi, Microbiol. Spectr., 2023, 11, e00336-23.
5. S. S. Ghosh, J. Wang, P. J. Yannie and S. Ghosh, J. Endocr. Soc., 2020, 4, bvz039.
6. A. Sontheimer-Phelps, D. B. Chou, A. Tovaglieri, T. C. Ferrante, T. Duckworth, C. Fadel, V. Frismantas, A. D. Sutherland, S. Jalili-Firoozinezhad, M. Kasendra, E. Stas, J. C. Weaver, C. A. Richmond, O. Levy, R. Prantil-Baun, D. T. Breault and D. E. Ingber, Cmgh, 2020, 9, 507–526.
7. M. Chi, B. Yi, S. Oh, D. J. Park, J. H. Sung and S. Park, Biomed. Microdevices, 2015, 17, 1–10.